水性质表
外观
此页面给出水的性質的补充数据。除非另有说明,否则数据均在标准状况测得。
结构和性质
[编辑]| 结构和性质 | |
|---|---|
| 折射率, nD | 1.333(20 °C) |
| 相对电容率[1] |
88.00(0 °C) |
| 键能 | 492.215 kJ/mol O–H键离解能[2] |
| 键长 | 95.87 pm(平衡)[3] |
| 分子结构 | 104.48°(平衡)[4][5] |
| 磁化率 | −9.04 × 10−6国际单位制体积单位[6] |
热力学性质
[编辑]| 相特性 | |
|---|---|
| 三相点 | 273.16 K(0.01 °C),611.73 Pa |
| 临界点 | 647 K(374 °C),22.1 MPa |
| 273.15 K熔化焓,Δ熔H | 6.01 kJ/mol |
| 273.15 K,1 bar熔化熵,Δ熔S | 22.0 J/(mol·K) |
| 标准汽化焓,Δ汽H |
44.0 kJ/mol |
| 373.15 K汽化焓,Δ汽H | 40.68 kJ/mol |
| 标准汽化熵,Δ汽S |
118.89 J/(mol·K) |
| 373.15 K汽化熵,Δ汽S | 109.02 J/(mol·K) |
| 273.15 K升华焓,Δ升H | 51.1 kJ/mol |
| 273.15 K,1 bar标准升华熵,Δ升S | ~144 J/(mol·K) |
| 摩尔凝固点常数 | −1.858 °C kg/mol |
| 摩尔沸点常数 | 0.512 °C kg/mol |
| 固态性质 | |
| 标准摩尔生成焓,ΔfH |
−291.83 kJ/mol |
| 标准摩尔熵,S |
41 J/(mol K) |
| 熱容量,cp | 12.2 J/(mol K)(−200 °C) 15.0 J/(mol K)(−180 °C) 17.3 J/(mol K)(−160 °C) 19.8 J/(mol K)(−140 °C) 24.8 J/(mol K)(−100 °C) 29.6 J/(mol K)(−60 °C) 32.77 J/(mol K)(−38.3 °C) 33.84 J/(mol K)(−30.6 °C) 35.20 J/(mol K)(−20.8 °C) 36.66 J/(mol K)(−11.0 °C) 37.19 J/(mol K)(−4.9 °C) 37.84 J/(mol K)(−2.2 °C) |
| 液态性质 | |
| 标准摩尔生成焓,ΔfH |
−285.83 kJ/mol |
| 标准摩尔熵,S |
69.95 J/(mol K) |
| 熱容量,cp | 75.97 J/(mol K),4.2176 J/(g·K)(0 °C) 75.42 J/(mol K),4.1921 J/(g·K)(10 °C) 75.33 J/(mol K),4.1818 J/(g·K)(20 °C) 75.28 J/(mol K),4.1814 J/(g·K)(25 °C) 75.26 J/(mol K),4.1784 J/(g·K)(30 °C) 75.26 J/(mol K),4.1785 J/(g·K)(40 °C) 75.30 J/(mol K),4.1806 J/(g·K)(50 °C) 75.37 J/(mol K),4.1843 J/(g·K)(60 °C) 75.46 J/(mol K),4.1895 J/(g·K)(70 °C) 75.58 J/(mol K),4.1963 J/(g·K)(80 °C) 75.74 J/(mol K),4.2050 J/(g·K)(90 °C) 75.94 J/(mol K),4.2159 J/(g·K)(100 °C) |
| 气态性质 | |
| 标准摩尔生成焓,ΔfH |
−241.83 kJ/mol |
| 标准摩尔熵,S |
188.84 J/(mol K) |
| 熱容量,cp | 36.5 J/(mol K)(100 °C) 36.1 J/(mol K)(200 °C) 36.2 J/(mol K)(400 °C) 37.9 J/(mol K)(700 °C) 41.4 J/(mol K)(1000 °C) |
| 熱容量,cv | 27.5 J/(mol K)(100 °C) 27.6 J/(mol K)(200 °C) 27.8 J/(mol K)(400 °C) 29.5 J/(mol K)(700 °C) 33.1 J/(mol K)(1000 °C) |
| 绝热指数, γ = cp/cv |
1.324(100 °C) 1.310(200 °C) 1.301(400 °C) 1.282(700 °C) 1.252(1000 °C) |
| 范德瓦耳斯常数 | a = 553.6 L2 kPa/mol2 b = 0.03049 L/mol |
液体物理性质
[编辑]

| 水中的声速 | |
|---|---|
| 25 °C蒸馏水 | 1498 m/s |
| 其它温度[7] | 1403 m/s(0 °C) 1427 m/s(5 °C) 1447 m/s(10 °C) 1481 m/s(20 °C) 1507 m/s(30 °C) 1526 m/s(40 °C) 1541 m/s(50 °C) 1552 m/s(60 °C) 1555 m/s(70 °C 1555 m/s(80 °C) 1550 m/s(90 °C) 1543 m/s(100 °C) |
| 密度[8][9] | |
| 0.983854 g/cm3 (−30 °C) | 0.99221 g/cm3(40 °C) |
| 0.993547 g/cm3 (−20 °C) | 0.99022 g/cm3(45 °C) |
| 0.998117 g/cm3 (−10 °C) | 0.98804 g/cm3(50 °C) |
| 0.9998395 g/cm3(0 °C) | |
| 0.999972 g/cm3(3.984 °C)[10] | 0.98570 g/cm3(55 °C) |
| 0.9999720 g/cm3(4 °C) | 0.98321 g/cm3(60 °C) |
| 0.99996 g/cm3(5 °C) | 0.98056 g/cm3(65 °C) |
| 0.9997026 g/cm3(10 °C) | 0.97778 g/cm3(70 °C) |
| 0.9991026 g/cm3(15 °C) | 0.97486 g/cm3(75 °C) |
| 0.9982071 g/cm3(20 °C) | 0.97180 g/cm3(80 °C) |
| 0.9977735 g/cm3(22 °C) | 0.96862 g/cm3(85 °C) |
| 0.9970479 g/cm3(25 °C) | 0.96531 g/cm3(90 °C) |
| 0.9956502 g/cm3(30 °C) | 0.96189 g/cm3(95 °C) |
| 0.99403 g/cm3(35 °C) | 0.95835 g/cm3(100 °C) |
| 温度低于0 °C时为过冷水。 | |
| 黏度[11] | |
| 1.7921 mPa·s (cP)(0 °C) | |
| 1.5188 mPa·s(5 °C) | 0.5064 mPa·s(55 °C) |
| 1.3077 mPa·s(10 °C) | 0.4688 mPa·s(60 °C) |
| 1.1404 mPa·s(15 °C) | 0.4355 mPa·s(65 °C) |
| 1.0050 mPa·s(20 °C) | 0.4061 mPa·s(70 °C) |
| 0.8937 mPa·s(25 °C) | 0.3799 mPa·s(75 °C) |
| 0.8007 mPa·s(30 °C) | 0.3635 mPa·s(80 °C) |
| 0.7225 mPa·s(35 °C) | 0.3355 mPa·s(85 °C) |
| 0.6560 mPa·s(40 °C) | 0.3165 mPa·s(90 °C) |
| 0.5988 mPa·s(45 °C) | 0.2994 mPa·s(95 °C) |
| 0.5494 mPa·s(50 °C) | 0.2838 mPa·s(100 °C) |
| 表面张力[12] | |
| 75.64 dyn/cm(0 °C) | 69.56 dyn/cm(40 °C) |
| 74.92 dyn/cm(5 °C) | 68.74 dyn/cm(45 °C) |
| 74.22 dyn/cm(10 °C) | 67.91 dyn/cm(50 °C) |
| 73.49 dyn/cm(15 °C) | 66.18 dyn/cm(60 °C) |
| 72.75 dyn/cm(20 °C) | 64.42 dyn/cm(70 °C) |
| 71.97 dyn/cm(25 °C) | 62.61 dyn/cm(80 °C) |
| 71.18 dyn/cm(30 °C) | 60.75 dyn/cm(90 °C) |
| 70.38 dyn/cm(35 °C) | 58.85 dyn/cm(100 °C) |
| 温度,°C | 电导率,μS/m |
|---|---|
| 0.01 | 1.15 |
| 25 | 5.50 |
| 100 | 76.5 |
| 200 | 299 |
| 300 | 241 |
水/蒸气平衡性质
[编辑]蒸气与液态水平衡的蒸气压公式[14]:
若T = 273 K至333 K:A = 7.2326;B = 1750.286;C = 38.1。
若T = 333 K至423 K:A = 7.0917;B = 1668.21;C = 45.1。
| 水蒸气表[15] | |||||
|---|---|---|---|---|---|
| 温度 (°C) |
压强 (kPa) |
液体H值 (J/g) |
Δ汽H (J/g) |
W汽 (J/g) |
蒸气ρ值 (kg/m3) |
| 0 | 0.612 | 0.00 | 2496.5 | 126.0 | 0.004845 |
| 10 | 1.227 | 42.0 | 2473.5 | 130.5 | 0.009398 |
| 20 | 2.336 | 83.8 | 2450.9 | 135.1 | 0.01728 |
| 30 | 4.242 | 125.6 | 2427.9 | 139.7 | 0.03036 |
| 40 | 7.370 | 167.2 | 2404.9 | 144.2 | 0.05107 |
| 50 | 12.33 | 209.0 | 2381.4 | 148.7 | 0.08285 |
| 60 | 19.90 | 250.8 | 2357.6 | 153.0 | 0.1300 |
| 70 | 31.15 | 292.7 | 2332.9 | 157.3 | 0.1979 |
| 80 | 46.12 | 334.6 | 2307.7 | 161.5 | 0.2931 |
| 90 | 70.10 | 376.6 | 2282.6 | 165.5 | 0.4232 |
| 100 | 101.32 | 419.0 | 2256.3 | 169.4 | 0.5974 |
| 110 | 143.27 | 460.8 | 2229.5 | 173.1 | 0.8264 |
| 120 | 198.50 | 503.2 | 2201.4 | 176.7 | 1.121 |
| 130 | 270.13 | 545.8 | 2172.5 | 180.2 | 1.497 |
| 140 | 361.4 | 588.5 | 2142.8 | 183.2 | 1.967 |
| 150 | 476.0 | 631.5 | 2111.8 | 186.1 | 2.548 |
| 160 | 618.1 | 674.7 | 2080.0 | 188.7 | 3.263 |
| 170 | 792.0 | 718.5 | 2047.0 | 190.6 | 4.023 |
| 180 | 1002.7 | 762.5 | 2012.2 | 192.8 | 5.165 |
| 190 | 1254.9 | 807.0 | 1975.8 | 194.5 | 6.402 |
| 200 | 1554.3 | 851.9 | 1937.3 | 195.6 | 7.868 |
| 210 | 1907.9 | 897.5 | 1897.5 | 196.3 | 9.606 |
| 221.1 | 2369.8 | 948.5 | 1850.2 | 196.6 | 11.88 |
| 229.4 | 2769.6 | 987.9 | 1812.5 | 196.2 | 13.87 |
| 240.6 | 3381.1 | 1040.6 | 1759.4 | 195.1 | 16.96 |
| 248.9 | 3904.1 | 1080.3 | 1715.8 | 193.7 | 19.66 |
| 260.0 | 4695.9 | 1134.8 | 1653.9 | 190.8 | 23.84 |
| 271.1 | 5603.4 | 1195.9 | 1586.5 | 186.9 | 28.83 |
| 279.4 | 6366.5 | 1240.7 | 1532.5 | 183.3 | 33.18 |
| 290.6 | 7506.2 | 1302.3 | 1456.3 | 177.4 | 39.95 |
| 298.9 | 8463.9 | 1350.0 | 1394.8 | 172.2 | 45.93 |
| 310.0 | 9878.0 | 1415.7 | 1307.7 | 164.2 | 55.25 |
| 321.1 | 11461 | 1483.9 | 1212.7 | 154.5 | 66.58 |
| 329.4 | 12785 | 1537.9 | 1133.2 | 145.6 | 76.92 |
| 340.6 | 14727 | 1617.9 | 1007.6 | 130.9 | 94.25 |
| 348.9 | 16331 | 1687.0 | 892.0 | 117.0 | 111.5 |
| 360.0 | 18682 | 1797.0 | 694.0 | 91.0 | 145.3 |
| 371.1 | 21349 | 1968.3 | 365.0 | 47.0 | 214.5 |
| 374.4 | 22242 | 2151.2 | 0 | 0 | 306.8 |
| 温度 (°C) |
压强 (kPa) |
液体H值 (J/g) |
Δ汽H (J/g) |
W汽 (J/g) |
蒸气ρ值 (kg/m3) |
上表中的数据给出了在液态水可存在的温度范围内各种温度下的水-蒸气平衡值。第二列给出平衡压强,单位为kPa。第三列是每克液体相对于0℃水的热含量。第四列是每克液体的汽化热。第五列是每克液体变成蒸汽所做的功PΔV。第六列是蒸气的密度。
各种压强下冰的熔点
[编辑]数据取自第44版《CRC化学和物理手册》第2390页。
| 压强/kPa | 温度/°C |
| 101.325 | 0.0 |
| 32950 | −2.5 |
| 60311 | −5.0 |
| 87279 | −7.5 |
| 113267 | −10.0 |
| 138274 | −12.5 |
| 159358 | −15.0 |
| 179952 | −17.5 |
| 200251 | −20.0 |
| 215746 | −22.1 |
冰的各种形式
[编辑]| 各种形式的冰的性质[16] | |||||
|---|---|---|---|---|---|
| 冰的 形式 |
密度 g/cm3 |
晶体 结构 |
三相点 | 三相温度 °C |
三相压强 MPa |
| Ih | 0.92 | 六方晶系 | 液、气、Ih | 0.01 | 0.000612 |
| 液、Ih、III | −22.0 | 207.5 | |||
| Ih、II、III | −34.7 | 212.9 | |||
| Ic | 0.92 | 立方晶系 | |||
| II | 1.17 | 六方晶系 | Ih、II、III | −34.7 | 212.9 |
| II、III、V | −24.3 | 344.3 | |||
| II、V、VI | −55(估计) | 620 | |||
| III | 1.14 | 四方晶系 | 液、Ih、III | −22.0 | 207.5 |
| 液、III、V | −17 | 346.3 | |||
| Ih、II、III | −34.7 | 212.9 | |||
| II、III、V | −24.3 | 344.3 | |||
| IV | 1.27 | 菱面体晶系 | |||
| V | 1.23 | 单斜晶系 | 液、III、V | −17 | 346.3 |
| 液、V、VI | 0.16 | 625.9 | |||
| II、III、V | −24.3 | 344.3 | |||
| II、V、VI | −55(估计) | 620 | |||
| VI | 1.31 | 四方晶系 | 液、V、VI | 0.16 | 625.9 |
| 液、VI、VII | 81.6 | 2200 | |||
| II、V、VI | −55(估计) | 620 | |||
| VI、VII、VIII | ≈5 | 2100 | |||
| VII | 1.50 | 立方晶系 | 液、VI、VII | 81.6 | 2200 |
| VI、VII、VIII | ≈5 | 2100 | |||
| VII、VIII、X | −173 | 62000 | |||
| VIII | 1.46 | 四方晶系 | VI、VII、VIII | ≈5 | 2100 |
| VII、VIII、X | −173 | 62000 | |||
| IX | 1.16 | 四方晶系 | |||
| X | 2.46 | 立方晶系 | VII、VIII、X | −173 | 62000 |
| XI‡ | 0.92 | 正交晶系 | 气、Ih、XI | −201.5 | 0(预期) |
| XII | 1.29 | 四方晶系 | |||
| XIII | 1.23 | 单斜晶系 | |||
| XIV | 1.29 | 正交晶系 | |||
‡XI三相点理论上存在,但从未有实验可得。
相图
[编辑]
氯化钠的水溶液
[编辑]
| NaCl,wt% | Teq,°C | ρ,g/cm3 | n | η,mPa·s |
|---|---|---|---|---|
| 0 | 0 | 0.99984 | 1.333 | 1.002 |
| 0.5 | −0.3 | 1.0018 | 1.3339 | 1.011 |
| 1 | −0.59 | 1.0053 | 1.3347 | 1.02 |
| 2 | −1.19 | 1.0125 | 1.3365 | 1.036 |
| 3 | −1.79 | 1.0196 | 1.3383 | 1.052 |
| 4 | −2.41 | 1.0268 | 1.34 | 1.068 |
| 5 | −3.05 | 1.034 | 1.3418 | 1.085 |
| 6 | −3.7 | 1.0413 | 1.3435 | 1.104 |
| 7 | −4.38 | 1.0486 | 1.3453 | 1.124 |
| 8 | −5.08 | 1.0559 | 1.347 | 1.145 |
| 9 | −5.81 | 1.0633 | 1.3488 | 1.168 |
| 10 | −6.56 | 1.0707 | 1.3505 | 1.193 |
| 12 | −8.18 | 1.0857 | 1.3541 | 1.25 |
| 14 | −9.94 | 1.1008 | 1.3576 | 1.317 |
| 16 | −11.89 | 1.1162 | 1.3612 | 1.388 |
| 18 | −14.04 | 1.1319 | 1.3648 | 1.463 |
| 20 | −16.46 | 1.1478 | 1.3684 | 1.557 |
| 22 | −19.18 | 1.164 | 1.3721 | 1.676 |
| 23.3 | −21.1 | |||
| 23.7 | −17.3 | |||
| 24.9 | −11.1 | |||
| 26.1 | −2.7 | |||
| 26.28 | 0 | |||
| 26.32 | 10 | |||
| 26.41 | 20 | |||
| 26.45 | 25 | |||
| 26.52 | 30 | |||
| 26.67 | 40 | |||
| 26.84 | 50 | |||
| 27.03 | 60 | |||
| 27.25 | 70 | |||
| 27.5 | 80 | |||
| 27.78 | 90 | |||
| 28.05 | 100 |
注:ρ为密度,n为589 nm光的折射率,η为黏度,均在20 °C测定;Teq<0–0.1°C时为冰/液态水溶解平衡温度,Teq>0.1 °C时为氯化钠/液态水溶解平衡温度。
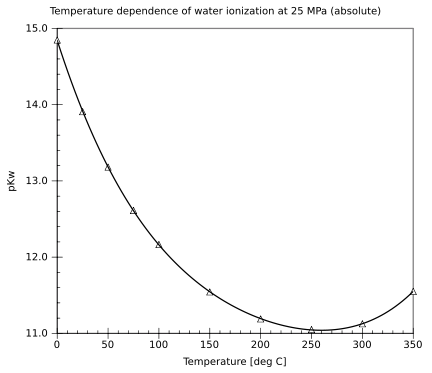
自电离
[编辑]| °C | −35 | 0 | 25 | 60 | 300 (~50 MPa) | |
|---|---|---|---|---|---|---|
| pKw[18] | 17 | 14.9 | 14.0 | 13.0 | 12 | |
谱图数据
[编辑]| 红外谱 | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 主要吸收波段[19] |
| |||||||||||||||
| 核磁共振波谱 | ||||||||||||||||
| 1H NMR | D2O:4.79 ppm;CDCl3:1.56 ppm;C6D6:0.40 ppm;CD3OD:4.87 ppm[20] | |||||||||||||||
| 13C NMR | 无[21] | |||||||||||||||
自扩散系数
[编辑]| 各温度下实验所得自擴散系数[22] | ||||||||||
| 温度(°C) | 系数(10−9 m2/s) | |||||||||
| 0 | 1.099 | |||||||||
| 1 | 1.138 | |||||||||
| 4 | 1.261 | |||||||||
| 5 | 1.303 | |||||||||
| 10 | 1.525 | |||||||||
| 15 | 1.765 | |||||||||
| 20 | 2.023 | |||||||||
| 25 | 2.299 | |||||||||
| 30 | 2.594 | |||||||||
| 35 | 2.907 | |||||||||
| 40 | 3.238 | |||||||||
| 45 | 3.588 | |||||||||
| 50 | 3.956 | |||||||||
| 56 | 4.423 | |||||||||
| 60 | 4.748 | |||||||||
| 70 | 5.615 | |||||||||
| 80 | 6.557 | |||||||||
| 90 | 7.574 | |||||||||
| 100 | 8.667 | |||||||||
磁化率
[编辑]20 °C(室温)下公认的水的磁化率标准值为−12.97 cm3/mol,−0.702 cm3/g[23]。
| 同位素异构体 及其状态 |
温度 (K) |
磁化率 (cm3/mol) |
|---|---|---|
| H2O(g) | >373 | −13.1 |
| H2O(l) | 373 | −13.09 |
| H2O(l) | 293 | −12.97 |
| H2O(l) | 273 | −12.93 |
| H2O(s) | 273 | −12.65 |
| H2O(s) | 223 | −12.31 |
| DHO(l) | 302 | −12.97 |
| D2O(l) | 293 | −12.76 |
| D2O(l) | 276.8 | −12.66 |
| D2O(s) | 276.8 | −12.54 |
| D2O(s) | 213 | −12.41 |
参考资料
[编辑]- ^ Lide, David R. CRC Handbook of Chemistry and Physics 85. CRC Press. 2004: 6–15 [2019-04-27]. ISBN 0-8493-0485-7. (原始内容存档于2019-06-09).
- ^ Maksyutenko, Pavlo; Rizzo, Thomas R.; Boyarkin, Oleg V. A direct measurement of the dissociation energy of water. The Journal of Chemical Physics. 2006, 125 (18): 181101. Bibcode:2006JChPh.125r1101M. PMID 17115729. doi:10.1063/1.2387163.
- ^ Cook, R; Delucia, F; Helminger, P. Molecular force field and structure of water: Recent microwave results. Journal of Molecular Spectroscopy. 1974, 53: 62. Bibcode:1974JMoSp..53...62C. doi:10.1016/0022-2852(74)90261-6.
- ^ Hoy, AR; Bunker, PR. A precise solution of the rotation bending Schrödinger equation for a triatomic molecule with application to the water molecule. Journal of Molecular Spectroscopy. 1979, 74: 1–8. Bibcode:1979JMoSp..74....1H. doi:10.1016/0022-2852(79)90019-5.
- ^ List of experimental bond angles of type aHOH. Computational Chemistry Comparison and Benchmark DataBase. (原始内容存档于2014-09-03).
- ^ Griffiths, David J. Instructor's solutions manual : Introduction to electrodynamics. New York: Prentice Hall. 1998: 275. ISBN 0138598517. OCLC 633685126.
- ^ Water and the Speed of Sound. www.engineeringtoolbox.com. [2008-04-29]. (原始内容存档于2008-04-23).
- ^ Lange, p. 1199. 由于当时使用的是公升的旧定义,将手册中的数据从旧的g/ml转换为g/cm3时,须乘以0.999973。
- ^ Lide, David R. CRC Handbook of Chemistry and Physics 70. Boca Raton, Florida: CRC Press. 1989-06-30. ISBN 978-0-849-30470-5.[页码请求]
- ^ Franks, Water a comprehensive treatise Volume 1 The Physics and Physical Chemistry of Water (页面存档备份,存于互联网档案馆).
- ^ David R. Lide CRC Handbook of Chemistry and Physics (页面存档备份,存于互联网档案馆) CRC Press, 2004, p. 6-201 ISBN 0-8493-0485-7.
- ^ Lange, p. 1663.
- ^ Revised Release on Viscosity and Thermal Conductivity of Heavy Water Substance (页面存档备份,存于互联网档案馆), The International Association for the Properties of Water and Steam Lucerne, Switzerland, August 2007.
- ^ Lange, p. 1436.
- ^ Lange, p. 1476.
- ^ Martin Chaplin. Water Phase Diagram. London South Bank University. [2008-01-21]. (原始内容存档于2016-03-03).
- ^ Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press: 8–71, 8–116, 2005, ISBN 0-8493-0486-5
- ^ Martin Chaplin. Ionization of water. London South Bank University. [2008-04-09]. (原始内容存档于2019-04-27).
- ^ Martin Chaplin. Water Absorption Spectrum. London South Bank University. [2008-04-10]. (原始内容存档于2019-04-27).
- ^ Fulmer et al. Organometallics, Vol. 29, No. 9, 2010
- ^ Gregory R. Fulmer, Alexander J. M. Miller, Nathaniel H. Sherden, Hugo E. Gottlieb, Abraham Nudelman, Brian M. Stoltz, John E. Bercaw, Karen I. Goldberg. NMR Chemical Shifts of Trace Impurities: Common Laboratory Solvents, Organics, and Gases in Deuterated Solvents Relevant to the Organometallic Chemist. Organometallics. 2010-05-10, 29 (9): 2176–2179 [2022-09-22]. ISSN 0276-7333. doi:10.1021/om100106e. (原始内容存档于2022-11-08) (英语).
- ^ Holz, Manfred; Heil, Stefan R.; Sacco, Antonio. Temperature-dependent self-diffusion coefficients of water and six selected molecular liquids for calibration in accurate 1
H NMR PFG measurements. Physical Chemistry Chemical Physics. 2000-01-01, 2 (20): 4740–4742. Bibcode:2000PCCP....2.4740H. ISSN 1463-9084. doi:10.1039/b005319h (英语). - ^ 23.0 23.1 Weast, Robert. CRC, Handbook of Chemistry and Physics 64th edition. Boca Raton, Florida: CRC publishing. 1983–1984: E–119. ISBN 0-8493-0464-4.
参考书目
[编辑]- Lange's Handbook of Chemistry, 10th ed. ISBN 0-07-016384-7(第15版)
- Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD), webbook
.nist .gov
| ||||||||||||||||||||||||||||||||||||||||


![{\displaystyle pK_{w}=-\log([\mathrm {H} ^{+}][\mathrm {OH} ^{-}])}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7dba46e853cb413eb22ac014a23a7f9b9fbceb56)
