甲酸锂
外观
| 甲酸锂 | |||
|---|---|---|---|
| |||
| 识别 | |||
| CAS号 | 556-63-8(无水物) 6108-23-2(一水合物) | ||
| PubChem | 23680280 | ||
| SMILES |
| ||
| 性质 | |||
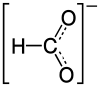
| 化学式 | CHLiO2 | ||
| 摩尔质量 | 51.97 g·mol−1 69.97 (一水合物) g·mol⁻¹ | ||
| 外观 | 白色晶体[1] | ||
| 密度 | 1.46 g·cm−3 (20 °C)[1] (一水合物) | ||
| 熔点 | 93-95 °C(366-368 K)(一水合物[1]) 279~280 °C(无水,熔化略带分解)[2]() | ||
| 溶解性(水) | 易溶于水 [1] | ||
| 相关物质 | |||
| 其他阴离子 | 乙酸锂 | ||
| 其他阳离子 | 甲酸钠 甲酸钾 甲酸铷 甲酸铯 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
甲酸锂是锂的甲酸盐。它以化学计量组成LiCOOH·H2O的白色晶体形式以一水合物形式销售。[3]
制备
[编辑]性质
[编辑]甲酸锂的晶体结构为正交晶系[5] ,空间群Pna21,晶格参数为a = 699 pm, b = 650 pm 和 c = 485 pm。[6]
甲酸锂的一水合物会在 94 °C 时失水,形成无水合物。[7] 把无水甲酸锂加热到 230 °C[6] 时,会分解成碳酸锂、一氧化碳和氢气。[4]
危险性
[编辑]与所有水溶性的锂盐一样,大量的甲酸锂对中枢神经系统有毒性作用。反复摄入甲酸锂也会损害肾脏细胞。 [8]
参考资料
[编辑]- ^ 1.0 1.1 1.2 1.3 Datenblatt 甲酸锂 bei AlfaAesar, abgerufen am {{{Abruf}}}.
- ^ https://pubs.rsc.org/en/content/articlepdf/1922/ct/ct9222101837
- ^ Template:Substanzinfo
- ^ 4.0 4.1 T. Meisel, Z. Halmos, K. Seybold, E. Pungor: "The thermal decomposition of alkali metal formates", in: Journal of Thermal Analysis and Calorimetry, 1975, 7 (1), S. 73–80 doi:10.1007/BF01911627
- ^ R. Abegg, F. Auerbach, I. Koppel: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, 1908. S. 149; Volltext.
- ^ 6.0 6.1 Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 532 (《甲酸锂》在Google Books的內容。).
- ^ Erich Groschuff: "Neutrale und saure Alkaliformiate. Studien über die Löslichkeit der Salze. XI.", in: Berichte der deutschen chemischen Gesellschaft, 1903, 36 (2), S. 1783–1795 doi:10.1002/cber.19030360276.
- ^ Template:Strem
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




![{\displaystyle {\ce {2HCOOLi ->[\Delta] Li2CO3 + CO ^ + H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd2481d55ca822cfb281260e5b48ec4ef1fd436e)