破骨细胞
| 破骨细胞 Osteoclast | |
|---|---|
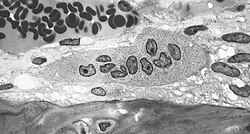 图中央为破骨细胞,可见破骨细胞有多个核。图下方的组织即骨组织,图左上方的结构为血 管 | |
| 基本信息 | |
| 位置 | 骨组织 |
| 功能 | 溶解破坏骨组织 |
| 标识字符 | |
| 拉丁文 | osteoclastus |
| MeSH | D010010 |
| TH | H2.00.03.7.00005 |
| FMA | FMA:66781 |
| 《显微解剖学术语》 [在维基数据上编辑] | |
破骨细胞(英语:osteoclast)又称蚀骨细胞[1],是一种存在于骨组织中的细胞,由多个单核细胞融合而成,直径最大可达100微米,细胞核的数目一般是6-50个[2][3]。破骨细胞由核因子B配体激活受体(RANKL),以及巨噬细胞集落刺激因子(M-CSF)刺激分化产生。它的主要功能是通过释放乳酸、柠檬酸、碳酸、碳酸酐酶及溶酶体酶等,对骨组织进行分解破坏[2],是体内唯一具有骨吸收活性的细胞[4][5][6]。
破骨细胞于1873年由德国的阿尔伯特·冯·科立克最早发现[7]。英语 osteoclast 中,osteo- 来自古希腊语 ὀστέον(osteon),意为骨;-clast 来自古希腊语 κλαστός(clastos),意为破坏。
在牙发育过程中,能吸收脱落乳牙牙根的破牙本质细胞与破骨细胞相似,两者存在一定的联系[8][9][10]。
结构
[编辑]

破骨细胞是起源于骨髓单核细胞的多核巨细胞。破骨前体细胞在趋化因子的作用下进入血循环[11],到达处于吸收状态的骨组织部位,在M-CSF和RANKL的作用下分化成破骨细胞[12]。人类破骨细胞通常具有五个紧密堆积的细胞核,直径为150-200µm。当使用趋化因子将巨噬细胞转化为破骨细胞时,可能会出现直径达到100µm的极大细胞,具有数十个细胞核,并且通常会表达主要的破骨细胞蛋白。由于不是天然的底物,因此与活骨中的细胞有显著差异[13][14]。多细胞核破骨细胞的大小使其能够将许多巨噬细胞的离子转运,同时蛋白质分泌和囊泡转运能力集中在骨头的局部区域。
骨吸收原理
[编辑]有研究发现,骨吸收能力是由破骨细胞数量及单个细胞降解骨基质的能力所决定[15]。在骨吸收过程中,破骨细胞会与骨基质接触,通过整合素αVβ3等分子的作用,使破骨细胞自身与骨表面之间形成一个独立的微环境。在破骨细胞内的溶酶体酶的作用下,经皱折缘排泌酸性物质,从而在破骨细胞和骨基质之间形成一个局部酸性微环境。酸性环境使骨中的矿物质溶解,暴露出其有机质部分,随后被组织蛋白酶K、抗酒石酸酸性磷酸酶 (TRACP) 及基质金属蛋白酶-9 (MMP-9) 等酶降解。抗酒石酸酸性磷酸酶主要存在于与破骨细胞膜相联系的微粒体内,参与骨基质中钙磷矿化底物的降解,可间接反映破骨细胞的活性及骨吸收的速率[16]。这些溶解的产物,如钙离子、弹性蛋白及蛋白多糖等均从细胞膜的皱折缘被吸收,然后进入到破骨细胞的转移小泡进行下一步处理,最终通过胞吐作用被转移出破骨细胞[17]。
抑制
[编辑]目前发现无细胞毒性的IgG2单克隆抗体地舒单抗(denosumab)[18]能够与RANK竞争性结合人类RANKL蛋白上的DE环结构。一方面活化了核因子活化B细胞κ轻链增强子 (NF-κB),后者进入细胞核影响相关基因的表达,对破骨细胞的活化、分化、增殖及多核化和生存起关键作用。另一方面,则抑制RANKL与破骨细胞及其前体表面的RANK结合,有效阻断配体与受体间的作用关系,从而抑制活化破骨细胞的形成、功能和存活,降低破骨细胞活性、抑制破骨细胞分化,进而阻碍肿瘤生长[19]。
参考资料
[编辑]- ^ 存档副本. [2022-11-27]. (原始内容存档于2022-11-27).
- ^ 2.0 2.1 章为等. 第四章 軟骨和骨. 組織學與胚胎學. 四川大学出版社. 2005: 35–36. ISBN 7-5614-2971-1.
- ^ Jain N, Weinstein RS. Giant osteoclasts after long-term bisphosphonate therapy: diagnostic challenges. Nat Rev Rheumatol. 2009, 5 (6): 341–6. PMID 19491914. doi:10.1038/nrrheum.2009.87.
- ^ Väänänen, HK; Laitala-Leinonen, T. Osteoclast lineage and function.. Archives of biochemistry and biophysics. 2008-05-15, 473 (2): 132–8 [2019-11-18]. PMID 18424258. doi:10.1016/j.abb.2008.03.037.
- ^ Indo, Y; Takeshita, S; Ishii, KA; Hoshii, T; Aburatani, H; Hirao, A; Ikeda, K. Metabolic regulation of osteoclast differentiation and function.. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2013-11, 28 (11): 2392–9 [2019-11-18]. PMID 23661628. doi:10.1002/jbmr.1976.
- ^ Ono, T; Nakashima, T. Recent advances in osteoclast biology.. Histochemistry and cell biology. 2018-04, 149 (4): 325–341 [2019-11-18]. PMID 29392395. doi:10.1007/s00418-018-1636-2.
- ^ Nijweidi Peter J.; Feyen, Jean H. M., Cells of Bone: Proliferation, Differentiation, and Hormonal Regulation, Physiological Reviews, 1986, 66 (4): 855–886, PMID 3532144
- ^ Odontoclast. Farlex, The Free Dictionary. 2007 [2013-11-06]. (原始内容存档于2013-12-16).
- ^ Wang Z, McCauley LK. Osteoclasts and odontoclasts: signaling pathways to development and disease. Oral Diseases. March 2011, 17 (2): 129–42. PMID 20659257. doi:10.1111/j.1601-0825.2010.01718.x.
- ^ K. Chatterjee. Essentials of Oral Histology. Jaypee Brothers Publishers. 1 December 2006: 155 [2018-05-06]. ISBN 978-81-8061-865-9. (原始内容存档于2014-01-11).
- ^ Adachi, JD; Lyles, KW; Colón-Emeric, CS; Boonen, S; Pieper, CF; Mautalen, C; Hyldstrup, L; Recknor, C; Nordsletten, L; Moore, KA; Bucci-Rechtweg, C; Su, G; Eriksen, EF; Magaziner, JS. Zoledronic acid results in better health-related quality of life following hip fracture: the HORIZON-Recurrent Fracture Trial.. Osteoporosis international : a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA. 2011-09, 22 (9): 2539–49. PMID 21249332. doi:10.1007/s00198-010-1514-9.
- ^ Kalbasi Anaraki, P; Patecki, M; Tkachuk, S; Kiyan, Y; Haller, H; Dumler, I. Urokinase receptor mediates osteoclastogenesis via M-CSF release from osteoblasts and the c-Fms/PI3K/Akt/NF-κB pathway in osteoclasts.. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2015-02, 30 (2): 379–88 [2019-11-09]. PMID 25196912. doi:10.1002/jbmr.2350.
- ^ Basle MF, Mazaud P, Malkani K, Chretien MF, Moreau MF, Rebel A. Isolation of osteoclasts from Pagetic bone tissue: morphometry and cytochemistry on isolated cells. Bone. 1988, 9 (1): 1–6. PMID 2837260. doi:10.1016/8756-3282(88)90020-8.
- ^ Jain N, Weinstein RS. Giant osteoclasts after long-term bisphosphonate therapy: diagnostic challenges. Nat Rev Rheumatol. 2009, 5 (6): 341–6. PMC 2860596
 . PMID 19491914. doi:10.1038/nrrheum.2009.87.
. PMID 19491914. doi:10.1038/nrrheum.2009.87.
- ^ Feng, X; Teitelbaum, SL. Osteoclasts: New Insights.. Bone research. 2013-03, 1 (1): 11–26 [2019-11-18]. PMID 26273491. doi:10.4248/BR201301003.
- ^ Zhu, Y; Wu, Y; Liang, Y; Tan, W; Liu, Z; Xiao, J. Regulation of expression level of fms-like tyrosine kinase-4 is related to osteoclast differentiation.. Archives of medical science : AMS. 2016-06-01, 12 (3): 502–6 [2019-11-18]. PMID 27279840. doi:10.5114/aoms.2015.55821.
- ^ Teitelbaum, SL. Bone resorption by osteoclasts.. Science (New York, N.Y.). 2000-09-01, 289 (5484): 1504–8 [2019-11-09]. PMID 10968780. doi:10.1126/science.289.5484.1504.
- ^ Eastell, R; Christiansen, C; Grauer, A; Kutilek, S; Libanati, C; McClung, MR; Reid, IR; Resch, H; Siris, E; Uebelhart, D; Wang, A; Weryha, G; Cummings, SR. Effects of denosumab on bone turnover markers in postmenopausal osteoporosis.. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2011-03, 26 (3): 530–7. PMID 20839290. doi:10.1002/jbmr.251.
- ^ 张萌萌. Denosumab與破骨細胞RANKL/RANK通路. 中国骨质疏松杂志. 2019, 25 (3): 386–388 [2019-11-08]. doi:10.3969/j.issn.1006-7108.2019.03.017. (原始内容存档于2019-11-08).
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
|
